摘要 摘要:以优化后的发酵培养基对植物乳杆菌的发酵液进行回用实验,采用摇瓶与 7L 发酵罐对发酵工艺过程中各阶段活菌数与乳酸的浓度变化进行了初步研究。在摇瓶阶段对植物乳杆菌与
摘要:以优化后的发酵培养基对植物乳杆菌的发酵液进行回用实验,采用摇瓶与 7L 发酵罐对发酵工艺过程中各阶段活菌数与乳酸的浓度变化进行了初步研究。在摇瓶阶段对植物乳杆菌与乳酸联产发酵的可行性进行验证,并在 7L 发酵罐上进行应用性尝试。研究结果表明:通过回用植物乳杆菌的发酵液能够使乳酸最终产量达到 150g/ L。在 7L 发酵罐规模下,发酵终点活菌数累积量达到 259× 108 CFU/ ml。
关键词:植物乳杆菌;乳酸;联产发酵;废液回用
植物乳杆菌(Lactobacillus plantarum)属乳杆菌属,属于同型发酵乳酸菌,是目前最常用的益生菌之一。广泛应用于青贮饲料的制作与益生菌剂的生产中,并且取得了良好效果[1-3] 。随着人们研究的不断深入,植物乳杆菌已成为乳酸菌研究领域的模式菌种,并有人将其形象地称为“自然代谢工程师”[4] 。在植物乳杆菌发酵过程中能够利用糖类发酵生产乳酸细菌[5] ,乳酸作为 21 世纪最具应用潜力的有机酸之一[6] 。广泛应用于食品行业及医药行业,同时乳酸还可作为防腐剂、酸味剂等应用于其他行业[7-8] 。在乳酸生产方面,吕乐等[9] 人通过改变乳酸菌发酵条件筛选出一株高产乳酸的乳酸菌 USTB-08,通过 pH 值控制得到了最高的乳酸产量为 30g/L。
植物乳杆菌用于益生菌剂生产时,主要采用分批发酵方式。发酵培养基中 K+ 和 Mg2+ 这些无机元素在发酵过程中主要起到调节细胞渗透压、作为酶的组成成分或维持酶的活性等作用[10] ,只有极少部分被菌体吸收,大量地将发酵液排放至大自然中,不仅浪费,还会造成环境的污染。而植物乳杆菌代谢过程中会产生一定浓度的乳酸[11] ,随着发酵液回用次数的增加,乳酸产量也在不断增加。因此,本研究期望对植物乳杆菌发酵液的回用来减少废水排放,并达到节能环保的目的,且在一定程度上降低了生产成本。同时实现植物乳杆菌与乳酸的高密度联产,为其他益生菌发酵提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 实验试剂 植物乳杆菌(Lactobacillus plantarum)由本实验室保藏;玉米浆、酵母粉由山东邹平鹤伴山生物科技有限公司提供;磷酸氢二甲,硫酸镁,硫酸锰,柠檬酸铵、葡萄糖、氨水、浓硫酸由北京北化精细化学品公司提供。
1.1.2 实验仪器 Bio-Rad 谱柱:美国 Beckman 公司;Sartorius arium 611UF 型纯水机:德国 Sartorius 公司;7200 型分光光度计:上 海 尤 尼 克 公 司 ;2695 型 HPLC: 美 国 Waters 公 司 ; DELTA320pH 计、电子天平:METTLER TOLEDO;LDZX-40B1 立式蒸汽压力灭菌器:上海申安医疗器械厂;SKP-01 电热恒温培养箱:黄石恒丰医疗器械有限公司;XL-90 型大容量离心机:美国 Beckman 公司;5L 全自动搅拌式发酵罐:上海百仑生物科技有限公司;高效液相色谱 LC-20AT:日本岛津公司。
1.1.3 培养基 种子培养基 (MRS)[12] :葡萄糖 20g/L,蛋白胨 10g/L,牛肉膏 10g/L,酵母粉 10g/L,磷酸氢二甲 2g/L,无水乙酸钠 5g/L,硫酸镁 0.2g/L,硫酸锰 0.05g/L,柠檬酸铵 2g/L,吐温 801ml/L,调 pH 至 6.5~6.8,于 121℃灭菌 30min。发酵优化培养基:葡萄糖 20,玉米浆 30,酵母粉 5,磷酸氢二甲 2,硫酸镁 0.2,硫酸锰 0.05,柠檬酸铵 2,调 pH 值至 6.5~6.8,于 121℃灭菌 30min。
1.2 实验方法
1.2.1 培养方法 活化培养:将保藏在 -60℃甘油管中的菌种少量接种于 MRS 液体培养基中,于 37℃静置培养 12h 后,将菌液均匀涂布于 MRS 固体培养基中继续培养 30h,挑单菌落进行划线,继续在 MRS 固体培养基中培养,将培养皿培养 24h 后,置于 -4℃冰箱中保藏备用。
1.2.2 种子与发酵培养 摇瓶培养,装液量 100ml,挑取培养皿中单菌落无菌接入种子培养基中,于 37℃恒温培养 12h。以 5%的接种量接入发酵培养基中,每隔 2h 检测菌体生长情况,发酵结束后。进行计数培养,之后离心收集发酵废液,为下次实验备用。 7L 发酵罐,装液量 4.8L,将保存在培养皿中的单菌落挑入种子培养基中,37℃,50r/min 培养 12h。将 200mL 种子液接种到 4.8L 优化后的发酵培养基的 7L 发酵罐中,37℃继续培养,发酵过程中搅拌速度改为 100r/min,以使溶质得到充分的混合,用氨水调控发酵液的 pH 值,将其控制在 6.5 左右。发酵期间通过补加 600g/L 高浓度的葡萄糖溶液控制底物浓度,整个发酵过程定时取样分析发酵液的细胞生物量。每次发酵结束后,进行计数培养,之后离心收集发酵废液,为下次实验备用。
1.2.3 发酵液回收利用方法 向离心后废液中补加葡萄糖至 20g/L[13] ,再向其中补加 30g/L 的玉米浆,于 121℃灭菌 30min。以相同接种量及装液量重新进行发酵培养,培养后做活菌计数,并测量发酵终点乳酸浓度。按上述方法不断回用发酵废液,直至最后批次发酵无菌体产生,且乳酸浓度不再变化。
1.2.4 发酵参数测定 通过测定发酵液在 600nm 处的吸光度来检测菌体生物量。将待测发酵液稀释适当倍数,使 OD600=0.3~0.8,采用 UNIC7200 分光光度计测定。乳酸含量测定采用高效液相色谱法(HPLC)。样品处理:精密量取发酵上清液 1mL,用超纯水定容至 5mL,得到乳酸的稀释待测液。测定时样品经 0.22um 微孔滤膜过滤。色谱条件:色谱条件:流动相为 0.005mol/L H2SO4,流速 0.4mL/min,柱温 55℃,进样量 10uL[14] 。
2 结果与讨论
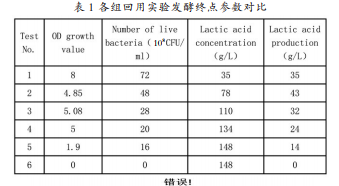
2.1 发酵液的多次回用(摇瓶)采用摇瓶培养新鲜发酵液,再依次按照 1.2.3 的方法进行发酵液的多次回用,当发酵液重复使用至第六批次时,发酵终点无菌体产生,且乳酸浓度没有任何变化,实验结果见表 1 与图 1。结果表明:新鲜发酵液的活菌数为 72×108 CFU/ml,乳酸产量为 35g/L。伴随发酵液回用次数的增加,菌体生长的延迟期逐渐变长,继而造成发酵周期延长。新鲜发酵液发酵过程中,OD600 的增长值为最大值 8,活菌数最高,乳酸产量相对较高。当发酵废液重复使用至第四批次时,发酵终点 OD600 增长值维持在 5 左右,而在发酵废液重复使用的过程中,发酵液每重复使用一次,发酵终点的活菌数依次降低,直至最后批次发酵过程中没有任何菌体产生。发酵废液重复使用一次时,乳酸产量达到最大,此代谢过程中乳酸产量为 43g/L。发酵废液重复使用第三次时,菌体乳酸代谢能力依次下降,当第五批次实验结束时,废液中乳酸浓度达到最大值,为 148g/L。此时各批次实验活菌计数总量为 184×108 CFU/ml。
2.2 发酵液的多次回用(7L 发酵罐)
在 上 述摇 瓶 实 验 阶段中,根据不同 批 次 废 液生 产 乳 酸 及发 酵 终 点 活菌 数 的 生 产情况,现进行 7L 发 酵罐 小试实验,新鲜发 酵 液 发 酵结束后,按照 1.2.3 中的 试验方法进行发酵液回用实验。 7L 发酵罐灭菌过程中会产生多余的蒸馏水,使发酵液回用时的初始乳酸浓度降低。各批次回用实验结果如表 2 及图 2。
结果表明,在分批补料发酵过程中,发酵液回用后发酵延迟期增加,导致发周期变长,新鲜发酵液 OD600 的增长值为最大值 19,活菌数最高为 123×108 CFU/ml,乳酸产量为 65g/L。当发酵废液重复使用至第三批次时,发酵终点 OD600 增长值维持在 5 左右,而在发酵废液重复使用的过程中,发酵液每重复使用一次,发酵终点的活菌数依次降低,直至最后批次发酵过程中没有任何菌体产生。发酵废液重复使用第二次时,菌体乳酸代谢能力依次下降,直至废液重复使用至第四批次时,乳酸 含 量没 有任 何 变化 ,此 时 发 酵 终 点 累 积 的 乳 酸 浓 度 为 150g/L。发酵过程中活菌数的总产量为 259×108 CFU/ml。 3 结论摇瓶实验表明,植物乳杆菌发酵液多次回用后,乳酸产量最终达到 148g/L, 乳酸产量较新鲜发酵液相比增加 3.3 倍,活菌数数累积量与新鲜发酵液相比增加 1.5 倍。而在 7L 罐规模发酵下,植物乳杆菌活菌数累积为 259×108 CFU/ml,较新鲜发酵液相比增加 1 倍左右,乳酸产量达到 150g/L。由此可见,通过对植物乳杆菌发酵液的回用提高了菌体及乳酸的产量,并减少了发酵培养基中无机盐的使用量,同时减少了发酵废水的排放。
参考文献
[1]徐志远.乳杆菌的肠道定殖和菌群调节作用研究[D].江苏:江南大学,2011.
[2]曲冬梅,刘小杰.植物乳杆菌及其在食品工业中的应用 [J]中国食品添加剂.2005,3,219-222.
[3]冯丽莉,张栋,荀一萍,薛玉玲,王世杰,朱宏.植物乳杆菌的功能性及工业化应用研究进展 [J]. 中国乳品工业,2018,36 (03):35-38.
乳酸联产发酵相关论文期刊你还可以浏览:《动物养殖过程中发酵棉粕的应用》
转载请注明来自:http://www.lunwenhr.com/hrlwfw/hrkjlw/11304.html