摘要 摘要:肠道共生微生物与机体免疫系统的相互作用机制尚未揭示。肠道共生微生物对哺乳动物的免疫系统有着重要的调节功能,反之哺乳动物的免疫系统在维持肠道共生微生物群稳态方面
摘要:肠道共生微生物与机体免疫系统的相互作用机制尚未揭示。肠道共生微生物对哺乳动物的免疫系统有着重要的调节功能,反之哺乳动物的免疫系统在维持肠道共生微生物群稳态方面也发挥着重要作用,以确保宿主正常生理功能得以发挥。文中对肠道共生微生物与免疫系统之间的相互作用及其机制进行综述,以期为肠道微生态与免疫系统发育互作机制的研究提供理论参考。
关键词:共生微生物,免疫系统,B淋巴细胞,T淋巴细胞
定植在脊椎动物体表的复杂微生物菌群被称为“微生物群”。肠道内共生的微生物菌群约有1014个,归于30属,500种[1]。共生微生物与宿主的相互作用对宿主的生理功能具有十分重要的意义。在肠道中定植的微生物能够降解各种植物多糖和其他膳食物质[2-3]。这就提高了宿主消化效率并保证了微生物的稳定营养供应。代谢效率可能是形成宿主-微生物群关系进化的潜在选择力[4]。然而,数百万年的共同进化已经在微生物群落及其宿主的生理机制之间形成了普遍的相互联系,并超越了代谢功能。这种相互作用关系在微生物与免疫系统之间尤为明显[5]。
例如,微生物能够促进宿主组织的分化,刺激免疫系统并保护宿主免受病原体侵袭[6-9]。此外,许多临床疾病与宿主相关微生物群落的变化有关,包括神经系统疾病、肥胖、营养不良、皮肤口腔和肠道中的各种炎性疾病[10-12]。本文概述了微生物与免疫系统之间相互作用的现状、面临的机遇和挑战。
1肠道共生微生物对免疫系统的调节作用
肠道微生物群是一个极其复杂的群体,在宿主免疫系统的发育和维持中起着至关重要的作用。肠道微生物群可以通过维持肠道屏障的完整性来稳定黏膜功能,通过诱导T淋巴细胞分化来维持炎症反应与免疫耐受之间的平衡,它还可以促进小鼠小肠固有层中早期B淋巴细胞的发育。
1.1肠道共生微生物对固有淋巴细胞的影响
固有淋巴细胞(Innatelymphoidcells,ILCs)是呈现淋巴样形态但缺乏重排的抗原受体样细胞,按照其功能和表型可将其分为3个亚组:ILC1、ILC2和ILC3[13]。大多数ILCs的生长发育受微生物菌群直接或间接地调控[8,14]。
例如,菌群鞭毛蛋白能够被肠道固有层中单核吞噬细胞的TLR5所识别,导致IL-23的分泌,从而增强RORγt+ILC产生IL-22,促使肠上皮细胞(Intestinalepithelialcells,IECs)释放Reg3γ[15]。研究表明,NKp46-Tbet-ILC3表达主要组织相容性复合体Ⅱ使其具有抗原递呈作用,促使CD4+T细胞耐受共生菌群的能力得以维持[16-17]。
1.2肠道共生微生物对B淋巴细胞的影响
人们一直认为B细胞发育的早期阶段主要在骨髓,但研究发现:在小鼠小肠固有层中存在有不同发育时期的B细胞,证实了小鼠小肠固有层是其B细胞发育的另一个位点,且固有层中的B细胞发育受到肠道微生物群的影响。与野生型小鼠相比,无菌小鼠小肠固有层中未成熟B细胞的数量明显减少[18]。Macpherson等[19]研究表明,共生微生物能够诱导IECs和单核吞噬细胞(Mononuclearphagocytes,MPs)分泌细胞因子,从而促进IgA类型转换并预防病原菌的感染。此外,微生物菌群对IgA的特异性也有调节作用[20]。
1.3肠道共生微生物对T淋巴细胞的极化及功能的影响
肠道内有大量的T淋巴细胞分布,它们参与各种免疫功能的调节。研究表明,微生物菌群对T细胞的极化及功能有着重要的调节作用(图1)[4],例如,肠道微生物群可以被宿主的TLR所识别,并激活MYD88和TRAM-TRIF信号通路产生调节T细胞极化的细胞因子,从而维持细菌耐受与免疫平衡[21]。目前研究证实,不同的微生物菌群对T细胞的免疫调节作用各不相同,如柔嫩梭菌群通过提高T细胞的调节功能来抑制由化学药物诱导的小鼠结肠炎[22]。
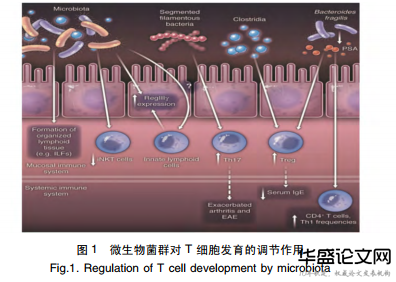
此外,研究发现梭状芽孢杆菌能够诱导CD4+Foxp3+Treg细胞在肠道固有层中聚集来抑制小鼠结肠炎并预防过敏反应[21]。自然杀伤T细胞(InvariantnaturalkillerT,iNKT)是一类具有NK受体和T细胞受体的淋巴细胞,并且能够显示NK细胞和T细胞特性。研究发现:无菌小鼠增加iNKT细胞介导的恶唑酮诱导的结肠炎和卵清蛋白诱导的哮喘具有易感性。出乎意料的是,只有小鼠在新生期暴露于微生物菌群时,这种效应才能得到缓和[4]。此外,一些肠道共生微生物的代谢产物在调节诱导Foxp3+iTreg的发育和分化方面起着非常重要的作用[23-24]。因此,肠道微生物对T淋巴细胞群发育和极化有着重要的调节作用。
2免疫系统对肠道共生微生物的影响
肠道微生物群对免疫系统的发育和功能进行着调节,与此同时,免疫系统也以某种方式调节着微生物菌群,使其保持在相对平衡的状态。由图2可见[25],IgA与共生多形拟杆菌结合可调节其基因的表达,此外IgA还调节共生菌群的组成。RORγt+ILCs产生的IL22诱导肠上皮细胞产生RegⅢγ限制分段丝状细菌(Segmentedfilamentousbacteria,SFB)的生长。SFB的过度生长能增加Th17细胞的数量和Th17细胞介导的肠道炎症。
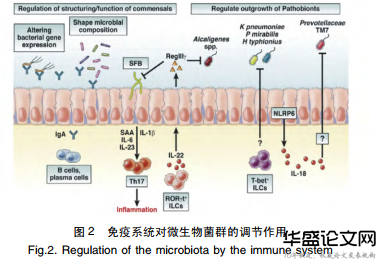
ILCs的T-bet表达限制了某些共生病原体的积累,例如肺炎克雷伯菌和奇异变形杆菌。但目前,免疫系统在调节微生物菌群中的作用仍在探索中。一些研究表明,相关免疫基因缺失小鼠与正常小鼠相比,肠道免疫系统所起到的作用不尽相同,不同的免疫基因发挥的作用不同,甚至可能是相反的,例如模式识别受体分子TLR5与NOD2在调节菌群的组成结构时,所表现出的结果是相反的[26-29]。
2.1固有免疫系统塑造肠道菌群
许多研究结果直接揭示了模式识别受体分子(PRRs)是通过它们的保守序列结构去识别肠道微生物的[30]。PRRs四大类模式识别受体主要包括TLR样受体、RIG-I样受体、NOD样受体和C型凝集素受体(CLECs)。试验表明:PRRs相关基因的敲除会引起菌群的失调[31]。TLR5基因缺失会发现鼠肠道菌群紊乱和代谢综合征的现象[25];CARD9基因缺失会引发菌群改变以致结肠炎的发生[32];NOD2基因缺失小鼠共生菌竞争抑制作用降低,引起阻止病原体在肠道定植能力下降,而肠道细菌感染的几率增加[27,33]。
此外,NOD2基因的表达与克罗恩病发生及肠菌素的生物合成都密切相关,且这一通路受大肠杆菌的影响,通过抑制杀菌酶而为大肠杆菌在肠道的生存提供条件[22]。C型凝集素受体分子与细菌功能密切相关并参与维持肠道稳态[34]。
2.2适应性免疫应答B淋巴细胞对肠道共生微生物的影响
研究发现,B细胞分泌的sIgA在调节菌群稳态方面起着重要的作用,sIgA除了能抑制细菌接近上皮细胞外,还能够促进肠道菌群多样性的稳定,从而保护肠上皮细胞应答反应[4,35-36]。
通过试验证实了sIgA是如何调节微生物菌群组成的,AIDG23S转基因小鼠能诱导活化胞嘧啶核苷脱氨酶的点突变导致体细胞高突变(Somatichypermutation,SHM)的缺陷而不是类别转换重组[37]。虽然小鼠不能进行SHM以保持肠IgA+B细胞的正常水平,但派尔集合淋巴结(Peyer'spatches,PPs)中B细胞显著增殖并增加它们对霍乱毒素和小肠结肠炎耶尔森氏菌的易感性[36],这说明刺激肠道菌群能诱导PPs中IgA+B细胞SHM,维持针对肠道菌群的高亲和力sIgA的分泌,平衡体液免疫应答。Wei等的研究表明,IgA和体细胞超突变在维持共生菌的稳态方面起着重要的作用[38]。在IBD疾病模型中可以通过特异性的IgA的产生来影响菌群的结构组成[39]。
2.3适应性免疫应答T淋巴细胞对肠道共生微生物的影响
研究发现,由RAG1-/-基因敲除而缺失获得性免疫的小鼠与野生型小鼠相比,有不同的微生物菌群组成[40]。肠道菌群可以对特异性T淋巴细胞通路产生影响,分段丝状细菌能够诱导肠Th17型T细胞活化而引起自身免疫性关节炎[32],双歧杆菌能促进抗肿瘤免疫反应的发生[41],梭菌属的混合菌可诱导肠道Treg细胞活化,抑制全身炎症反应,肠道菌群还与自身免疫疾病相关,如类风湿性关节炎与多发性硬化[42-43]。
微生物-免疫系统相互作用的研究与相关研究技术的快速发展密不可分。目前,随着肠道微生物基因组计划的实施,培养组学、宏基因组学、功能基因组学、代谢组学、蛋白质组学、二代高通量测序、体外模拟肠道发酵系统、体外培养肠道结合微流控技术、无菌动物模型和类器官培养技术的不断发展,通过分析肠道中微生物群落的组成、分布、功能、生理生化特征、相互关系及其与宿主间相互作用提供了强大技术支撑[44-48],这为更好地研究微生物-免疫系统相互作用的机制提供了前所未有的机遇。
完全了解微生物-免疫系统相互作用的关系,这是一个大的科学问题,急需阐明揭示。例如,共生微生物如何影响免疫细胞如Th17和Tregs细胞的分化?为什么有些动物B细胞的发育需要或依赖肠道正常菌群?而有些种类却不需要,这是不是由不同动物的免疫系统进化史的不同而造成的?是哪种微生物或者其代谢产物在这些过程中发挥作用?现在人们越来越关注微生物-免疫系统相互作用研究。
一方面,免疫系统能够调节和塑造微生物菌群,另一方面,定植的微生物菌群能够促进宿主的免疫系统发育并且能为随后的免疫应答提供信号。目前,对微生物-免疫系统之间相互作用的了解仍然存在很大的局限,这些疑惑需要综合多学科协调创新才能破解,仍然还有很长的路要走。坚信通过全世界本领域及其相关领域科学家们的共同努力,一定能够揭示肠道微生物与免疫系统之间相互作用的科学奥秘,最终为科学服务于人类健康提供令人振奋的新篇章。
参考文献:
[1]ConsortiumHMP.Structure,functionanddiversityofthehealthyhumanmicrobiome[J].Nature,2012,486:207-214.
[2]CockburnDW,KoropatkinNM.Polysaccharidedegradationbytheintestinalmicrobiotaanditsinfluenceonhumanhealthanddisease[J].JournalofMolecularBiology,2016,428(16):3230-3252.
[3]DudachodakA,TarkoT,SatoraP,etal.Interactionofdietarycompounds,especiallypolyphenols,withtheintestinalmicrobiota:areview[J].EuropeanJournalofNutrition,2015,54(3):325-341.
[4]HooperLV,DanRL,MacphersonAJ.Interactionsbetweenthemicrobiotaandtheimmunesystem[J].Science,2012,336:1268-1273.
[5]BelkaidY,HarrisonOJ.Homeostaticimmunityandthemicrobiota[J].Immunity,2017,46(4):562.
[6]HondaK,LittmanDR.Themicrobiotainadaptiveimmunehomeostasisanddisease[J].Nature,2016,535:75.
[7]AymericL,SansonettiP.Chapter50-siscriminatingpathogensfromcommensalsatmucosalsurfaces[J].MucosalImmunology,2015:975-984.
[8]ThaissCA,ZmoraN,LevyM,etal.Themicrobiomeandinnateimmunity[J].Nature,2016,535:65.
[9]SommerF,BckhedF.Knowyourneighbor:microbiotaandhostepithelialcellsinteractlocallytocontrolintestinalfunctionandphysiology[J].BioessaysNews&ReviewsinMolecularCellular&DevelopmentalBiology,2016,38(5):455-464.
[10]VillanuevamillánMJ,PérezmatuteP,OteoJA.Gutmicrobiota:akeyplayerinhealthanddisease:Areviewfocusedonobesity[J].JournalofPhysiology&Biochemistry,2015,71(3):509-525.
转载请注明来自:http://www.lunwenhr.com/hrlwfw/hrnylw/10031.html